Az oxigén molekulatömege. Mi az oxigén móltömege?
Az elemek és molekulák atomjai rendelkeznekelhanyagolható tömeg. A kémiai reakciókra jellemző mennyiségi viszonyok tanulmányozásához számos fizikai mennyiséget használnak. Az egyik az atomok, ionok és molekulákra számítható moláris tömeg. A Föld egyik legfontosabb eleme az oxigén, sok reakció és folyamat zajlik a részvételével. A számítások elvégzésére a vegyületek képletével a reakcióegyenletek az oxigén móltömegét használják, amely számszerűen megegyezik atomjának vagy molekulájának relatív tömegével.
oxigén
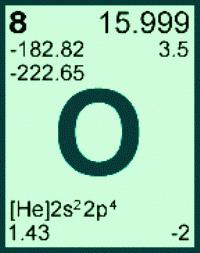
Általános információ oxigénről (kémiai elem):
- a latin név Oxygenium;
- kémiai szimbólum - O;
- a periodikus táblázat 16. csoportjának (korábban VI A csoportja) felső részén van;
- a második fluoreszcencia után közvetlenül a nitrogén után;
- a kalkogének családjába tartozik;
- az időszakos tábla elemének száma és atomjainak atomjainak töltése 8.
Az oxigén, mint a légkör egyik komponense hosszúaz idő nem tud tiszta formában megkülönböztetni. A gáz neve "életet adó", "az élet elixírja". Az oxigén felfedezésének tiszteletét világszerte elismert tudósok osztják egymás között: K. Scheele, J. Priestley, A. Lavoisier. Az "oxigén" kifejezést A. Lavoisier javasolta, az anyag fontos szerepétől, az atomok oxidok és savak képződésétől.

Hogyan lehet megtalálni egy elem vagy anyag moláris tömegét?
Kémiai számítások végrehajtása során tudnia kellaz atomok és molekulák reakciójában résztvevő anyagok tömege. De túl kicsiek, ami megnehezíti az olyan egységek használatát, mint a gramm és a kilogramm. Megállapítottuk, hogy más számokat javasoltak a számítások megkönnyítésére. Például a kémiában az atom és molekulatömeg relatív értékeit alkalmazzák. Az atom (Ar) relatív tömegét fizikai mennyiségként vezették be 1961-ben. Ennek értéke a szén-atom tömegének 1/12-e (izotóp 12C).
Ha ezt és más változókat használva formulák és egyenletek segítségével számításokat végez, több szabályt kell figyelembe venni:
- Az atom tömegét a kémiai jel melletti periódusos táblázat mutatja. A moláris tömeg azonos számértékű, de mérési egységgel g / mol.
- Az anyag egy móltömegét a vegyület képletével határozzuk meg, amelynél a molekula összes részecskéinek móltömegének összege megtalálható.
- Ha a kémiai képletnek van egy mutatója, amely jelzi a szerkezeti egységek számát, akkor ezt a koefficienst meg kell szorozni a moláris tömeggel.
Az oxigén atom és molekulatömege
Az oxigénatom tömegét aa három természetes izotóp mennyiségét és eloszlását: Ar (O) = 15.999 (ae m-ben). A számításokban ez az érték általában lekerekített, kiderül, hogy 16. Minden egyes elem esetében atomtömege állandó érték. A 8 sorszámú elem atomjának ismert tömege szerint az oxigénelem moláris tömege megtalálható. M (O) = 16. Egy másik dimenzió nélküli fizikai mennyiség, az oxigén molekulatömege egy egyszerű anyagra utal. Számítsuk ki az oxigénmolekula tömegét úgy, hogy az atom tömegét sztöchiometrikus együtthatóval megszorozzuk a képletben: Mr (O2) = Ar (O) . 2 = 16 . 2 = 32. A gyakorlatban nincs szükség arra, hogy megtudjuk, mi az oxigén móltömege, mivel az értéke numerikusan megegyezik az anyag molekulájának tömegével, de egy g / mol mérési egységgel. Egy adott vegyület esetében molekulatömege állandó, amelyet széles körben alkalmaznak az anyag mennyisége és tömegének kiszámítása során.

Az anyag mennyisége
A kémia területén, a számítások kényelmében, egya legfontosabb fizikai mennyiségek - az anyag mennyisége. Nem a tömegre, hanem a szerkezeti egységek számára utal. Egy anyag mennyisége a nemzetközi rendszerben (SI) 1 mól. Tudva, hogy 1 mol annyi részecskét tartalmaz, mint amennyi 12 g szén-izotóp 12C, lehet számítani az atomok számát, molekulákat, ionokat,bármely anyag mintájában lévő elektronok. Egy másik állandó értéket a nagy olasz tudós, az Avogadro nevezte el (NA), Azt jellemzi, hogy mennyi szerkezeti részecskét tartalmaz egy anyag, ha mennyisége 1 mól. Az Avogadro konstans számszerű értéke 6,02 . 1023 1 / mol. Pontosan ez az atomok száma (molekulák, ionok), amelyek moláris tömege van. A fizikai mennyiség megnevezése M, a mérési egység 1 g / mol, a számítási képlet M = m / n (m a tömeg (g), n az anyag mennyisége (mol)).
Mi az oxigén móltömege?
A gyakorlatban nincs szükség a használatáraaz M = m / n képlet alapján, az oxigén móltömeg kiszámításához. A problémák megoldásakor gyakran szükséges meghatározni, hogy mi a tömeg, vagy hogy mennyi az anyag mennyisége. Az első esetben a képlet m = n . M, a második - n = m / M. Az elem moláris tömegének számszerű értéke megegyezik az atom tömegével, és az anyag molekulákkal. Például egy 16 gramm tömegű anyag 1 mol oxigént tartalmaz. M (O2) Az oxigénmolekula móltömege 32 g / mol.
Az oxigénegyenérték moláris tömege
Az egyenérték az 1 tömeggel megegyező mennyiségegy monovalens elem atomjának mólja. Az általános esetben meg lehet határozni az ekvivalens tömegt úgy, hogy egy kémiai elem atomjai móltömegét elosztjuk egy adott vegyülettel alkotott vegyértékével. A legtöbb vegyületben az oxigén, mint kémiai elem - a kalkogén, kétértékű. Az oxigén móltömege megtalálható a Mendelejev asztaltól, lekerekített értéke 16. Az ekvivalens tömeg kétszer kisebb, mint 8. A kémia az ekvivalensek törvényét használja, amely kimondja, hogy az anyagok egymással egyenértékű mennyiségben reagálnak. A számítások során az egyenértékű oxigén móltömegét használhatja annak az anyagnak az egyenértékének a tömegére, amelyre ismeretlen.

Az oxigén az egyik legfontosabb eleme a földfelszíneknekkéreg, a tömeg 46,6% -át teszi ki. Egyszerű kapcsolat ugyanarról a névről a második leggyakoribb a Föld légkörében. A levegőben lévő molekuláris oxigén mennyisége 20,947 térfogat%. Az elem atomjainak és molekuláinak részvételével sok reakció és folyamat zajlik a mérnöki, ipari, élő és élettelen természetben. Fontos figyelembe venni a mennyiségi kapcsolatokat ezen folyamatokban, ami nagymértékben megkönnyíti a fizikai mennyiségek használatát, beleértve az oxigén móltömegét.
</ p>

