Elektrolitok: példák. Az elektrolitok összetétele és tulajdonságai. Erős és gyenge elektrolitok
Elektrolitok mint vegyi anyagok ismertekősi időkben. Azonban a legtöbb alkalmazási területük viszonylag új keletű. Az iparágban az anyagok felhasználásának legfontosabb területét megvitatjuk, és megértjük, hogy mit képvisel ez utóbbi és hogyan különböznek egymástól. De kezdjünk egy történelmi túrán.

történet
A legrégebbi ismert elektrolitok a sók és a sóksavak, amelyeket az ókori világban fedeztek fel. Azonban az elektrolit szerkezetével és tulajdonságaival kapcsolatos ötletek idővel alakultak ki. E folyamatok elmélete az 1880-as évek elején alakult, amikor számos felfedezést végeztek, az elektrolit tulajdonságainak elméleteivel kapcsolatban. Számos minőségi ugrást tapasztaltunk az elektrolitok vízzel való kölcsönhatásának mechanizmusát leíró elméletekben (valójában csak oldatban kapják azokat az tulajdonságokat, amelyek az iparban használják őket).
Most részletesen elmélkedünk néhány elméletről,amely a legnagyobb hatást gyakorolta az elektrolitokra és azok tulajdonságaira vonatkozó elképzelések kifejlesztésében. És kezdjük el a leggyakoribb és legegyszerűbb elméletet, hogy mindannyian átléptünk az iskolában.
Az elektrolitikus disszociáció elmélete Arrhenius
1887 - ben a svéd vegyész Svante Arrhenius ésAz orosz-német kémikus Wilhelm Ostwald létrehozta az elektrolitikus disszociáció elméletét. Azonban itt sem túl egyszerű. Arrhenius maga támogatta a megoldások úgynevezett fizikai elméletét, amely nem vette figyelembe az alkotóelemek vízzel való kölcsönhatását, és azt állította, hogy az oldatban szabad töltött részecskék (ionok) vannak. Egyébként az ilyen pozíciókból az elektrolitikus disszociáció az iskolában ma tekinthető.
Beszéljünk még mindig arról, hogy mit ad ez az elmélet és hogyan magyarázza meg az anyagok vízzel való kölcsönhatásának mechanizmusát. Mint minden máshoz, számos olyan posztulátummal rendelkezik, amelyeket használ:
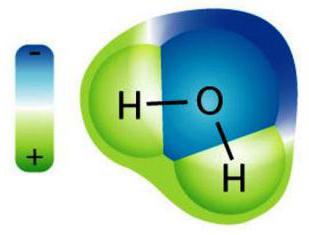
1. Vízzel való kölcsönhatás esetén az anyag bomlik ionokká (pozitív - kation és negatív anion). Ezek a részecskék hidratálódnak: vonzanak olyan vízmolekulákat, amelyek mellesleg pozitív töltésűek az egyik oldalon, másrészt - negatívan (dipol formájában), ennek eredményeként akvakomplexekké (szolvátokká) alakulnak.
2. A disszociáció folyamata reverzibilis - vagyis ha az anyag ionokat felbomlott, akkor egyes tényezők hatására újra bekerülhet a kezdeti folyamatba.
3. Ha csatlakozik az oldat elektródák és a hagyja, hogy a jelenlegi, a kationok kezd mozogni, hogy a negatív elektród - a katód és anionok a pozitív töltésű - anód. Ezért az anyagok jól oldódnak vízben, vezeti az áramot jobb, mint maga a víz. Ugyanezen okból elektrolitnak nevezték őket.
4. Az elektrolit disszociációjának mértéke a feloldódott anyag százalékát jellemzi. Ez az indikátor az oldószer és a legelnyeltebb anyag tulajdonságaitól, az utóbbi koncentrációjától és a külső hőmérséklettől függ.
Itt, valójában, és ennek minden alapvető álláspontjátegyszerű elmélet. Ezeket a cikkeket arra használják, hogy leírják, mi történik az elektrolit oldatban. E vegyületek példáit később tárgyaljuk, de most egy másik elméletet vizsgálunk.

Lewis savak és bázisok elmélete
Az elektrolitikus disszociáció elmélete szerint savegy olyan anyag, amelynek oldatában hidrogén-kation van, és a bázis olyan vegyület, amely oldatban hidroxid-aniontá bomlik. Van egy másik elmélet, amelyet a híres Gilbert Lewis vegyész nevére neveznek el. Ez lehetővé teszi számunkra, hogy kissé kibővítsük a sav és az alap fogalmát. Lewis elmélet szerint a savak olyan ionok vagy molekulák, amelyeknek szabad elektrontranszformációja van, és képesek egy másik molekulából elektronot venni. Könnyű kitalálni, hogy a bázisok olyan részecskék lesznek, amelyek képesek egy vagy több elektront adni a sav "felhasználására". Nagyon érdekes itt, hogy a sav vagy a bázis nemcsak elektrolit lehet, hanem bármilyen vízben oldhatatlan anyag is.

Brandsted-Lowry prototípus-elmélete
1923-ban egymástól függetlenül kettőa tudósok - J. Brønsted és T. Lowry - elméletet javasoltak, amelyet a tudósok aktívan használnak a kémiai folyamatok leírására. Ennek az elméletnek a lényege, hogy a disszociáció jelentése a protonnak a savtól a bázishoz való átvitelére korlátozódik. Így az utóbbit itt proton-akceptorként értjük. Ezután a sav a donoruk. Az elmélet jól magyarázza a tulajdonságokat és savakat és bázisokat mutató anyagok létezését. Az ilyen vegyületeket amfoternek nevezzük. Elméletileg Bronsted-Lowry azok távon is érvényes amfolit, mivel sav vagy bázis általában úgynevezett protoliths.
Eljöttünk a cikk következő részébe. Itt ismertetjük, hogy a különböző erős és gyenge elektrolitok különböznek egymástól, és megvitassák a külső tényezők tulajdonságaikra gyakorolt hatását. Aztán elkezdjük leírni gyakorlati alkalmazásukat.
Erős és gyenge elektrolitok
Minden anyag kölcsönhatásban van a vízzelkülön-külön. Néhányan jól feloldódnak benne (pl. Asztali só), és egyesek egyáltalán nem oldódnak (pl. Kréta). Így minden anyag erős és gyenge elektrolitokra oszlik. Az utóbbiak olyan anyagok, amelyek rosszul kölcsönhatásba lépnek a vízzel, és az oldat alján helyezkednek el. Ez azt jelenti, hogy nagyon alacsony fokú disszociáció és magas kötési energia van, ami nem teszi lehetővé, hogy a molekula normál körülmények között bomlódjon fel alkotóionjába. A gyenge elektrolitok disszociációja nagyon lassan vagy az oldat hőmérsékletének és koncentrációjának növekedésével jön létre.
Beszéljünk erős elektrolitokkal. Ezek közé tartoznak az összes oldható sók, valamint az erős savak és lúgok. Ezek könnyedén bomlanak ionokká, és nagyon nehéz őket összegyűjteni a csapadékban. Egyébként az elektrolitok áramát pontosan az oldatban lévő ionok végzik. Ezért a legjobb elektrolit vezeti az áramot. Az utóbbiak példái: erős savak, lúgok, oldható sók.

Az elektrolitok viselkedését befolyásoló tényezők
Most nézzük meg, hogyan változik a külsőaz anyagok tulajdonságaira vonatkozó helyzet. A koncentráció közvetlenül befolyásolja az elektrolit disszociációjának mértékét. Ezenkívül ez a kapcsolat matematikailag is kifejeződhet. A kapcsolatot leíró törvényt az Ostwald hígítási törvényének nevezik, és a következőképpen íródik: a = (K / c)1/2. Itt az a a disszociáció mértéke (be van vetvefrakciók), K a disszociációs állandó, minden egyes anyag esetében különböző, és c az oldat elektrolitkoncentrációja. E képlet szerint sokat tanulhat az anyagról és annak megoldási viselkedéseiről.
De elhagytuk a témát. A koncentráció mellett a disszociáció mértékét befolyásolja az elektrolit hőmérséklete is. A legtöbb anyag esetében növekedése növeli az oldhatóságot és a kémiai aktivitást. Ez az, hogy bizonyos reakciók folyamatát csak magas hőmérsékleten tudja megmagyarázni. Normális körülmények között nagyon lassan vagy mindkét irányba megy (ez a folyamat visszafordíthatónak nevezhető).
Elemeztük azokat a tényezőket, amelyek meghatározzák az elektrolit oldat rendszerének viselkedését. Most viszont kétségtelenül nagyon fontos vegyi anyagok gyakorlati alkalmazása felé fordulunk.

Ipari felhasználás
Természetesen mindenki hallotta az "elektrolit" szót,az elemekre. Az autó ólom-savas elemeket használ, az elektrolit szerepe 40 százalékos kénsavval. Annak megértéséhez, hogy miért van szükség erre az anyagra, meg kell érteni az akkumulátor jellemzőit.
Tehát mi az elve az akkumulátornak? Bennük az egyik anyag másikba való átalakulásának reverzibilis reakciója zajlik le, melynek következtében az elektronok szabadulnak fel. Amikor az akkumulátor fel van töltve, olyan anyagok kölcsönhatása van, amelyeket normál körülmények között nem kapnak. Ez a kémiai reakció eredményeként az anyagban lévő elektromosság felhalmozódása lehet. A kisülés elindulása után megkezdődik a fordított átalakulás, ami a rendszer kezdeti állapotába vezet. Ez a két folyamat együttesen egy töltés-kisülési ciklust jelent.
Tekintsük a fenti folyamatot egy konkrétpélda - ólom savas akkumulátor. Amint azt feltételezed, ez az áramforrás ólmot (valamint ólom-dioxid PbO-t) tartalmaz2) és savak. Bármelyik akkumulátor elektródából és a közöttük lévő térből áll, melyet csak elektrolit töltött fel. Az utolsó, mint már kifejtettük, példánkban a kénsavat 40 százalékos koncentrációban alkalmazzuk. Az ilyen elem katódja ólom-dioxidból készül, és az anód tiszta ólomból áll. Mindez azért van, mert ezen a két elektródon különböző reverzibilis reakciók vannak ionokkal, amelyekhez a sav disszociálódik:
- PbO2 + SO42-+ 4H+ + 2e- = PbSO4 + 2H2O (a negatív elektród-katódon bekövetkező reakció).
- Pb + SO42- - 2e- = PbSO4 (Pozitív elektróda anódon folyó reakció).
Ha elolvassuk a reakciókat balról jobbra, akkor megkapjukaz akkumulátor lemerülése esetén bekövetkező folyamatok, és ha jobbról balra - töltés közben. Mindegyik kémiai áramforrásban ezek a reakciók különbözőek, de az áramlás mechanizmusát általában ugyanolyan módon írják le: két folyamat fordul elő, amelyek közül az egyikben az elektronok "felszívódnak", a másik pedig "kimegy". A legfontosabb dolog az, hogy az elnyelt elektronok száma megegyezik a felszabadult elektronok számával.
Valójában az elemek mellett van egy tömegezen anyagok alkalmazását. Általában az elektrolitok, amelyek példáit idéztük, csak egy sor olyan anyagból álló szemcsék, amelyek ebben a kifejezésben egységesek. Mindenütt, mindenütt körülveszik minket. Itt például az emberi test. Gondolod, hogy ezek az anyagok nincsenek ott? Nagyon rossz. Mindenütt bennünk vannak, és a legnagyobb szám a vér elektrolitjai. Ezek közé tartoznak például a hemoglobin részét képező vasionok, és segítenek oxigént szállítani a testünk szöveteihez. A vér elektrolitjai kulcsszerepet játszanak a víz-só egyensúlyának és a szív munkájának szabályozásában is. Ezt a funkciót kálium- és nátriumionok hajtják végre (van még egy folyamat is, amely a sejtekben történik, amit kálium-nátrium-szivattyúnak neveznek).
Minden olyan anyag, amely feloldhatólegalább egy kis elektrolit. És nincs olyan ágazat és az életünk veled, bárhol is alkalmazzák őket. Nem csak akkumulátorok és akkumulátorok. Ez mindenféle kémiai és élelmiszertermelés, katonai gyárak, ruházati gyárak és így tovább.
Az elektrolit összetétele egyébként más. Így lehetséges a sav és lúgos elektrolit elkülönítése. Alapvetően különböznek tulajdonságaikban: amint azt már említettük, a savak protonok és alkáli-akceptorok adományozói. Azonban az elektrolit összetételének megváltozása az anyag egy részének elvesztése következtében a koncentráció csökken vagy növekszik (minden attól függ, hogy mi az elveszett, víz vagy elektrolit).
Minden nap szembesülünk velük, de nagyon kevesen ismerik pontosan egy kifejezést, mint az elektrolit. Példák konkrét anyagokra, szétszereltünk, ezért haladjunk tovább valamivel összetettebb fogalmakra.

Az elektrolitok fizikai tulajdonságai
Most a fizikáról. A legfontosabb dolog, hogy megértsük, mikor tanulmányozzuk ezt a témát, hogy hogyan áramlik az áram elektrolitokban. Ebben a döntő szerepet játszik az ionok. Ezek a töltött részecskék az oldat egy részéből a másikba szállíthatók. Így az anionok mindig a pozitív elektródához, a kationokhoz pedig a negatív elektródhoz tartoznak. Így a megoldással elektromos áram mellett a rendszer különböző oldalain oszlik meg a töltés.
Nagyon érdekes fizikai jellemző,mint a sűrűség. A vegyületek számos tulajdonsága attól függ. És gyakran felmerül egy kérdés: "Hogyan növelhető az elektrolit sűrűsége?" Valójában a válasz egyszerű: a megoldás víztartalmát csökkenteni kell. Mivel az elektrolit sűrűségét elsősorban a kénsav sűrűsége határozza meg, ez főleg az utóbbi koncentrációjától függ. Ennek két módja van. Az első nagyon egyszerű: forraljuk fel az akkumulátort tartalmazó elektrolitot. Ehhez fel kell töltenie, hogy a belső hőmérséklet némileg meghaladja a száz Celsius fokot. Ha ez a módszer nem segít, ne aggódj, van még egy: egyszerűen cserélje ki a régi elektrolitot egy újval. Ehhez csavarja le a régi oldatot, tisztítsa meg a kénsav maradványait desztillált vízzel, majd öntsön egy új adagot. Általánosságban az elektrolit minőségi megoldásai azonnal megkövetelik a koncentráció szükséges értékét. A csere után elfelejtheti, hogyan növelheti az elektrolit sűrűségét sokáig.
Az elektrolit összetétele nagymértékben meghatározzatulajdonságait. Az ilyen elektromos vezetőképesség és sűrűség például nagymértékben függ az oldott anyag természetétől és koncentrációjától. Van külön kérdés, hogy mennyi elektrolit lehet az akkumulátorban. Tény, hogy mennyisége közvetlenül kapcsolódik a termék bejelentett kapacitásához. Minél több kénsav van az akkumulátor belsejében, annál erősebb, annál nagyobb a feszültség.

Hol hasznos?
Ha egy autó rajongó vagy éppen lelkesautók, akkor mindent megértetek. Biztosan tudod még megmondani, hogy mennyi elektrolit van az akkumulátorban. És ha távol állsz az autótól, akkor ezeknek az anyagoknak az ismerete, alkalmazásuk és egymással való kölcsönhatása nem lesz felesleges. Ennek tudatában nem lesz veszteség, ha megkérdezik, hogy melyik elektrolit van az akkumulátorban. Bár még akkor sem, ha nem egy autó rajongó, de van egy autója, az akkumulátoros eszköz ismerete nem lesz felesleges és segít javításban. Sokkal könnyebb és olcsóbb mindent megtenni, mint menni az autóközpontba.
És hogy jobban megismerhessük ezt a témát, javasoljukolvassa el az iskolák és egyetemek kémia tankönyvét. Ha jól ismeri ezt a tudományt és elég könyveket olvas, akkor a legjobb lehetőség a Varypaev "Kémiai forrásai". Az akkumulátortelepek, a különböző elemek és a hidrogénelemek működésének teljes elméletét részletesen bemutatjuk.
következtetés
Véget értünk. Összefoglaljuk. A fentiektől szétszedtünk mindent, ami egy olyan koncepcióhoz kapcsolódik, mint az elektrolitok: példák, struktúra és tulajdonságok elmélete, funkciói és alkalmazásai. Ismét érdemes megemlíteni, hogy ezek a vegyületek az életünk részét képezik, amely nélkül a testünk és az iparág minden szférája nem létezhet. Emlékszel a vérelektrolitokra? Köszönjük nekik, hogy élünk. Mi a helyzet a gépekkel? Ennek a tudásnak köszönhetően meg tudjuk oldani az akkumulátorral kapcsolatos problémákat, mivel most már megértjük, hogy hogyan növelhető az elektrolit sűrűsége.
Mindent nem lehet elmondani, és nem tettünk ilyen célt. Végtére is, ez nem minden, amit lehet tudni ezekről a csodálatos anyagokról.
</ p>